面对依然严峻复杂的疫情,未来论坛联合科学、医药、临床等领域内的知名专家,并特邀一刻talks共同推出“《理解未来》科学讲座:病毒与人类健康-专题科普”,全方位专业解读病毒及流行病相关领域知识,深度分析谣言与真相、乐观或恐慌!
在3月16日的第一期直播中,栏目邀请到了现任北京生命科学院研究所资深研究员 李文辉博士,带来了《从科普到专业:了解新冠病毒感染及如何阻断的药理研究》的主题分享。从病毒复制的机制,侵入细胞受体的机制,给大家非常通俗的讲了药物研发的基本科学知识。
下面分享的是李文辉博士的演讲全文:
我今天的演讲第一部分会抛砖引玉,介绍病毒的基本知识和病毒防控的重要概念。第二部分,介绍冠状病毒的特点,尤其是它的侵入过程以及可能的药物应用。

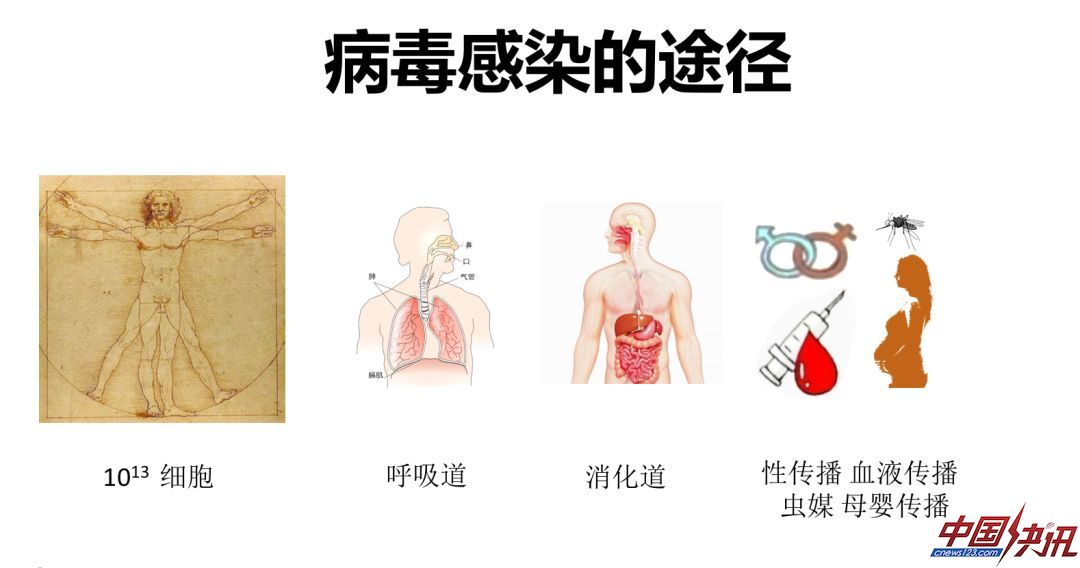
人类世界上有很多的病毒,病毒是生态环境的一部分。病毒可在家畜或者野生动物之间传播,也可在人间传播,尤其是病毒引起的新发传染病,对人类来说是长期存在的威胁。我们处于病毒的汪洋大海中,但却并没有感染很多病毒。人体有10^13细胞,皮肤作为人体表面最大器官对所有病毒不易感,病毒要进入人体需要有自己的通道。这一通道就是人体和外界相通的通道,包括呼吸道、消化道、生殖道,以及通过蚊虫叮咬、输血传播和母婴传播。
病毒是严格的细胞内寄生生物,主要原因是病毒没有自己的能量系统,也没有自己的物质系统,它只能提供遗传信息和少量的蛋白质及其他物质(复制)。病毒必须通过特定通道进入细胞,这个通道称为受体。进入细胞以后,在细胞质和细胞核里面分别进行复制。
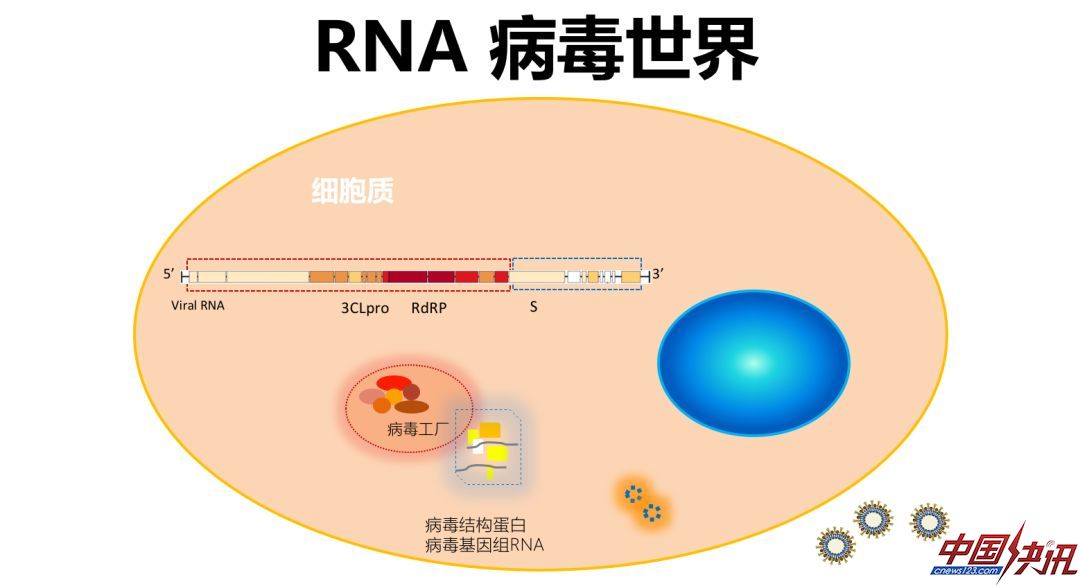
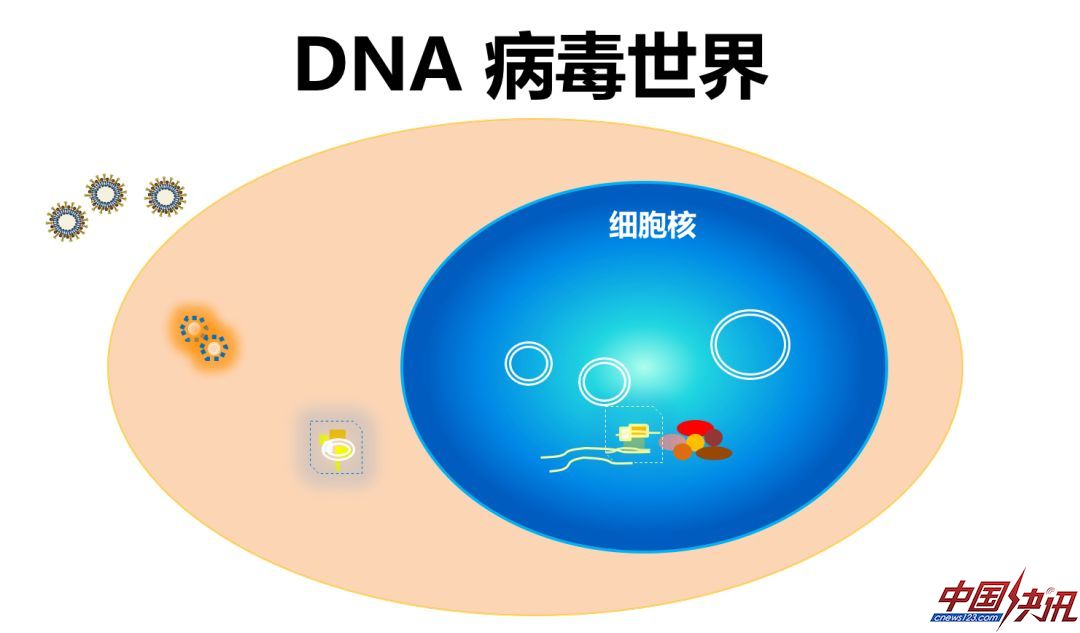
病毒可以分为两大类,存在RNA病毒和DNA病毒两个病毒世界。RNA病毒绝大部分在细胞质内复制,包括此次新型冠状病毒和大部分的新发病毒,以及常见的丙肝等等;绝大部分的DNA病毒都在细胞核内复制,包括常见的疱疹病毒、乳头瘤病毒等等,但也存在在细胞质内复制的DNA病毒,如痘病毒,也就是天花病毒,天花病毒是目前唯一已经被人类疫苗彻底消灭的病毒,其他的病毒即使有很好的疫苗也没有完全根除。在这两个病毒世界之间,还有一种跨界病毒,通过从RNA到DNA的逆转录的过程实现复制,如:HIV和HBV。病毒用最精简的方式复制,携带的核心是它的遗传物质,它的遗传物质在哪儿复制,是整个病毒生命的核心和最关键的要素。
对于RNA病毒,它在细胞质内复制,病毒的基因组大致包括两部分,一是它的复制酶区域,二是它的结构基因区域。例如冠状病毒,它的基因组是一个长的正链RNA,翻译产生不同的蛋白质。基因组各部分保守性不同,图上红色区域表示保守性非常高,颜色递减表示保守性减弱。RNA病毒进入细胞后可在“病毒工厂”中,进行基因复制和基因表达,产生病毒结构蛋白和基因组RNA,两者组装成完整RNA病毒以后释放,至此完成它自己的生活史。
RNA病毒必须在细胞质里面连续地、活跃地复制,才能长期存在于细胞中。这意味着RNA病毒中任何一个关键酶或关键蛋白缺失或者被损伤,病毒都不能进行连续的复制。这为病毒抑制提供了多个作用靶点,任何一个(关键)靶点被有效地抑制,病毒都能被有效抑制。在(抗)RNA病毒中最成功的例子就是丙肝病毒,丙肝病毒有六七个靶点,其中任何一个靶点被抑制,病毒都会被有效抑制,多个靶点同时作用就会最终消灭它。对于冠状病毒来说,有两个重要的酶,一个是蛋白酶,一个是依赖于RNA的RNA聚合酶(RDRP),抗病毒药物瑞德西韦如果能够有效地抑制RDRP活性,便可抑制病毒复制。
DNA病毒是完全不一样的世界,DNA病毒主要存在于细胞核中,同时产生它的结构蛋白、非结构蛋白和基因组。正常情况下可以持续不断地复制。但是DNA病毒和RNA病毒有一个巨大不同在于,DNA病毒在细胞核内也可以不复制,依然能够长期存在。换句话说,病毒DNA的多聚酶抑制剂,比如阿昔洛韦虽抑制了HSV病毒的复制,但是病毒本身的遗传物质在宿主细胞核里依旧可以长期存在,很难被消除。这个长期存在当然有一系列的基础,比如它利用了细胞本身的DNA修复机制,能够维持它的基因组完整性。与此相反,RNA病毒基因组在细胞质里不能得到维持和维护,它更像一次性的,用了就扔了。
乙肝病毒是介于RNA和DNA之间的一个病毒,它在细胞核里的共价闭合环状DNA(cccDNA)也是长期存在的,但它的复制可以被RNA逆转录酶的抑制剂抑制。RNA病毒和DNA病毒在生物学上有巨大不同,在病毒学者看来,RNA病毒只要研究得足够深入,找到合适的靶点,可以像丙肝一样被消灭。对于DNA病毒来说,它的路要长得多。
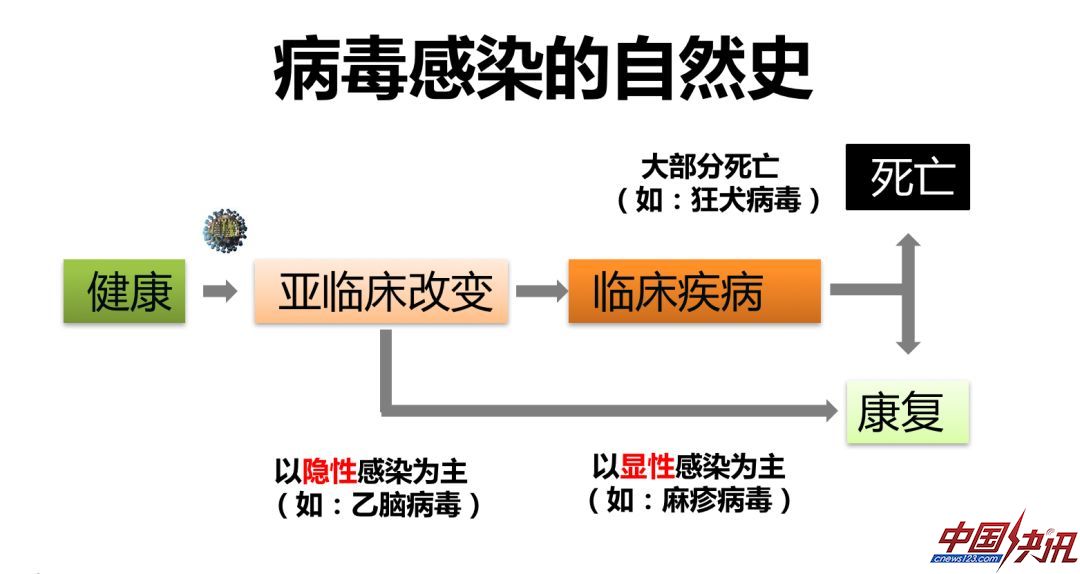
不管DNA或者RNA病毒在分子层面的表现如何,在个体层面,病毒感染都有它的自然史。病毒感染以后,会出现几种结局。一种是只经历亚临床的改变最终康复,另一种是从亚临床改变到临床疾病,最后或者康复、或者死亡。但是由于病毒本身的特性不同,宿主个体的差异不同,病毒的自然史在个体水平上是有差别的。比如,有些病毒感染是隐性感染为主,如乙型脑炎病毒,大部分感染没有明显的临床症状。乙脑病毒最终靶点在脑部神经元,但是在有病毒血症的时候感染的是外周器官。而麻疹病毒等是以显性感染为主,感染完都会发病,以临床疾病作为最主要的突出表现。另外一个极端的例子就是狂犬病毒,只要感染,如果没有及时进行疫苗接种、特免血清或者抗体的注射,病人都会死亡。
刚才我介绍的是病毒学的一些基本概念和我们对它的理解。下面我给大家介绍一下我们对于新冠病毒感染从机制到应用的一些想法。
冠状病毒是一大类RNA病毒,第一例于1937年从禽类分离出来的禽传染性支气管炎病毒,第一例人冠状病毒是1965年从一个小男孩的鼻腔内的充气部位分离出来,当时接种了该病毒的健康志愿者也被感染发病。冠状病毒是已知的最大的RNA病毒,它的基因组将近30K。如此巨大的一个病毒, RNA的聚合酶保真性和RNA的稳定性都会有一定的问题。为什么冠状病毒依然能稳定存在成为最大的RNA病毒呢?其中很重要的原因是它的复制酶中有一个外切核糖核酸酶,这个酶有一定程度上的校对功能,能够使冠状病毒保持基因组的稳定性。另一方面来说,冠状病毒有最大的基因组,也意味着它有最多的靶点。人类对于这个病毒进行深入的研究,我个人认为可以找到有效的靶点,从而有效地进行治疗。
冠状病毒,要通过细胞膜进入宿主细胞。这个过程的关键是细胞膜受体和冠状病毒的刺突蛋白的结合。这种结合过程相当于一个酶的催化过程,病毒的膜和细胞膜首先发生半融合,然后再完全融合,两个膜完全融合以后,病毒的核衣壳进入细胞里面,从而完成病毒复制的第一步,也是非常关键的一步。
在这次新冠病毒以前已经有6种可感染人的冠状病毒,最早发现的是229E病毒,最晚的是MERS。新冠病毒主要进入人体呼吸道,它的传播效率很高,但是它的病死率并不是很高。它的重要病理特点是有肺泡上皮的弥漫性损伤和多核巨细胞形成。这和病毒侵入最早的一步,也就是受体结合病毒的进入是有关系的。
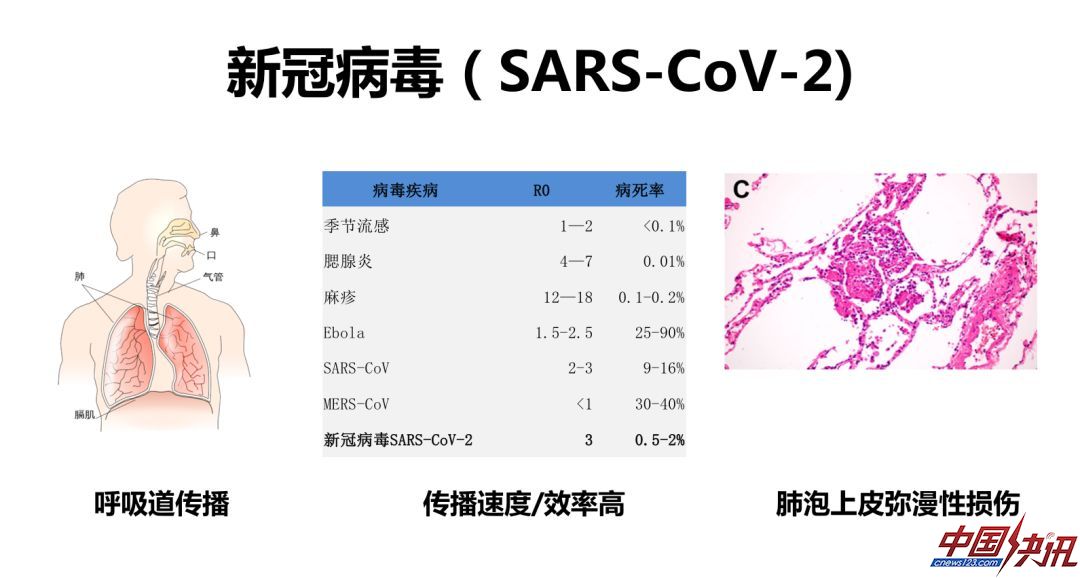
新冠病毒被发现以后,石正丽老师组很快证明不敏感细胞转染ACE2受体以后,可以被新冠病毒感染,后来Pohlmann用实验证明阻断ACE2受体可以阻断新冠病毒的感染,这样看来从充分性和必要性都可以证明ACE2在细胞培养水平是新冠病毒主要的受体。我们在早期也确定了ACE2是SARS病毒必要和充分的受体。但是在人体层面ACE2是什么样子呢?首先要看它在各器官的表达。ACE2在包括肺脏在内的很多器官内有表达。最新的报道表明,ACE2在口腔的很多细胞中也有表达,提示我们这和一部分病人仅仅是在上呼吸道发生病毒复制,而没有在下呼吸道复制从而造成严重疾病有关。但是这个假设目前还未研究清楚。
除ACE2之外,另外一个膜蛋白酶TMPRSS2也可以促进冠状病毒尤其是SARS和新冠病毒的感染。TMPRSS2和ACE2叠加分布,可能和新冠病毒多器官损伤有关。但是TMPRSS2在器官损伤中发挥的作用并没有比ACE2大,原因是在HCov-229E感染中也需要TMPRSS2的参与,但是HCov-229E显然是自限性的疾病。当然,受体和辅助因子的表达也只是疾病发生发展中的一个因素,还有其他因素也在参与其中,这需要以后更多的研究。

在人群水平上ACE2是什么样子的?ACE2是在人的X染色体的短臂。(图)最新一篇文章分析了中国人的基因组的MAP和千人基因组结果,发现在编码区有30多个核苷酸多态性位点,有意思的是多态性的位点和已知的病毒感染位点都没有重合。意味着不存在对新冠病毒有天然抵抗力的人群存在。
这一点和乙肝病毒受体NTCP有很大不同。NTCP最主要在肝脏表达,不会在其他器官表达。在人群水平,NTCP有一个在267位的S变成F的突变位点,这个突变在中国南方人群中比北方多,这个突变能够使人具有部分抵抗HBV感染的能力,已经被流行病学调查所证实。总之,从病毒学角度看,一个病毒可以像HBV一样,有高度的组织器官特异性,也可以像SARS一样,有多器官的侵入和感染。
冠状病毒由病毒的刺突蛋白介导进入人体细胞,结构生物学的研究使我们对于一些重要的冠状病毒结构,有了非常直观和比较深入的了解。新冠病毒和SARS冠状病毒一样,刺突蛋白都是三聚体结构,可分成几个结构域,图中绿色部分是和感染最相关的受体结合域(RBD),它有突起和放下两种构象,在突起构象下可以和细胞膜受体结合。
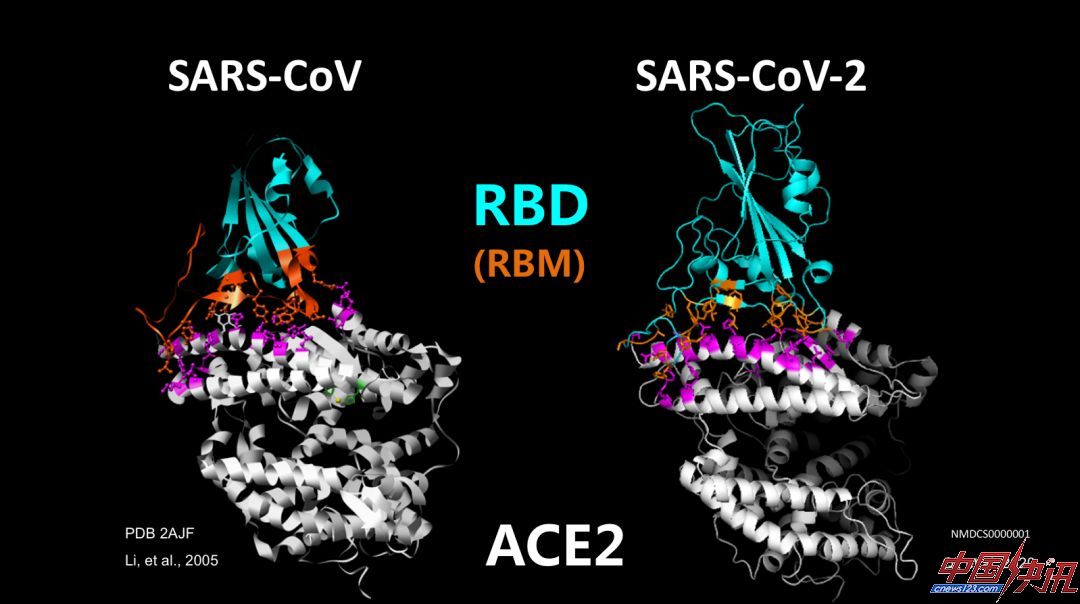
在原子层面看病毒与受体结合可以发现,新冠病毒和2005年发现的SARS病毒与ACE2的结合模式相同和结合机制相似。从空中往下鸟瞰看病毒与受体结合在受体上留下的足迹,可以看到新冠病毒的足迹和SARS病毒的足迹在很多地方是重合的,当然也有不一样的地方,这意味着它们有相同的结合模式和相似的机制。
受体和受体结合域的结合能够决定感染效率。比较新冠病毒分别与人、蝙蝠和穿山甲ACE2结合的能力,可以看到新冠病毒的RBD和人结合的相当强,和穿山甲也非常强,和蝙蝠的ACE2结合相对弱一些。对于病毒溯源来说,还需要看(动物)新冠(类似)病毒和不同ACE2的结合。
前面我提到由ACE2介导的病毒的侵入过程,如何阻断病毒侵入呢?我想分享一下对于大分子药物的一些想法。
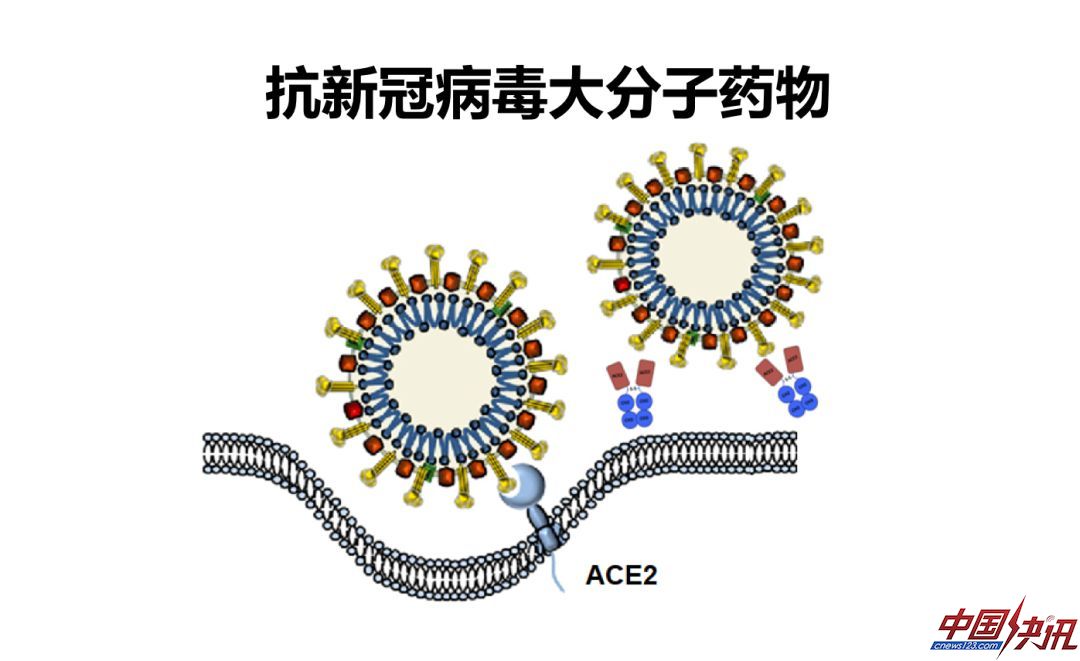
大分子药物相对小分子药物有很多优势,包括给药次数少、安全性高,耐药屏障高,不受免疫优势表位的影响。对疫苗接种反应不好的群体包括婴幼儿、老年人都有效。
当然也有它的限制,比如给药方式不便、生产工艺复杂、成本比较高等问题。
大分子药物的研发也有很好的先例,比如RSV的帕利珠单抗,当然还有一系列的流感病毒和HIV单抗目前正在临床实验中。
抗新冠病毒的大分子药物本质上可以分为两种,一种是抗体,包括抗ACE2抗体和抗S蛋白抗体,另一种是融合蛋白,包括RBD-Fc融合蛋白和ACE2-Fc融合蛋白,他们作用机制的共同点是阻断新冠病毒和ACE2的结合,当然它们有各自的优缺点。比如ACE2-Fc融合蛋白能够有效地中和病毒,病毒难以逃逸,可以“以不变应万变”。它的缺点也比较明显,比如它的工艺复杂和亲和率一般。抗体是大分子药物很重要的武器,抗体的优点是比较成熟,缺点是病毒对抗体容易产生突变,使抗体作用失效。
新冠病毒的受体结合域是紧促的,它是独立折叠的一个区域,可以被重组表达用于抑制病毒的感染。RBD-Fc融合蛋白在早期实验中已经被证明可以用于有效阻挡SARS病毒的感染。
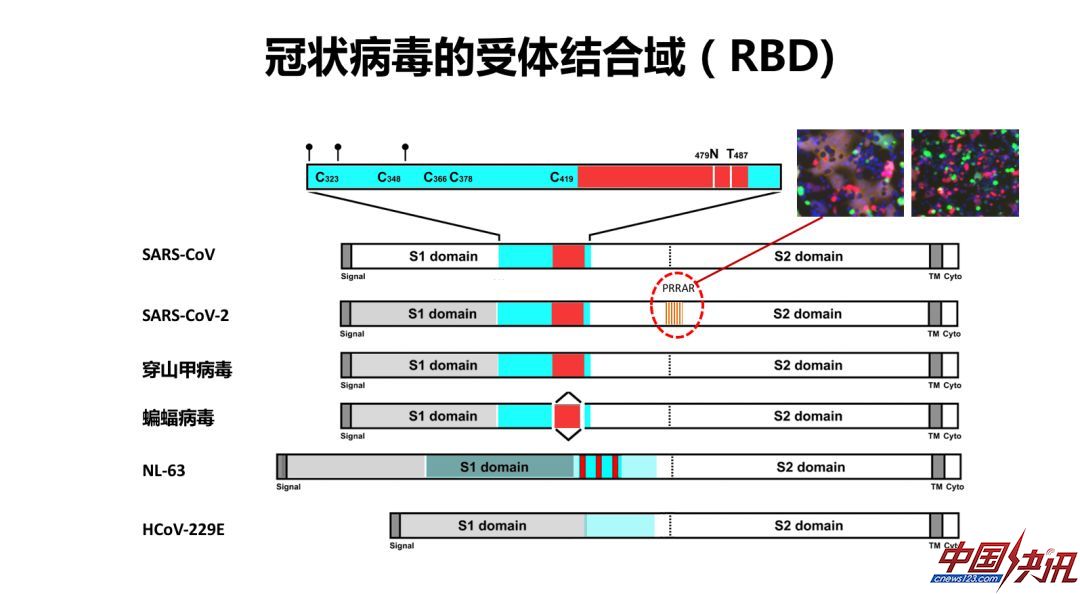
对于特异性中和抗体来说,最早的针对SARS的中和抗体是2004年发现的针对RBD的抗体,称为80R。在领域内有很多小组都在很积极地研发针对新冠病毒的抗体,新冠病毒抗体最容易拿到的也是针对RBD的抗体,将来可以考虑表位更不容易变化和不容易逃逸的其他地方的抗体,但这些难度比较大。
对于新冠病毒来说,大分子药物面临的主要挑战,最重要的有两个,第一个病毒是否有细胞和细胞间的传播,病毒是否可以避开受体结合进入细胞?对于乙肝病毒来说,这是不可能的。但是有些病毒是可以进行细胞间传播的,比如说HIV,可以有细胞间的传播,这种细胞间的传播会妨碍大分子药物的作用效率。
对于冠状病毒来说,研究比较多的是冠状病毒小鼠MHV,在MHV里面有自己的蛋白受体,也可以有唾液酸的受体,它们俩相互配合可以帮助病毒进入细胞。传播阶段,唾液酸也可以帮助完成细胞与细胞间的传播。新冠病毒的受体是ACE2,是不是有唾液酸和糖分子的参与目前并不知道。但是新冠病毒基因组上并没有编码RDE的基因,RDE是以糖类进行扩散的病毒必须的酶,新冠病毒并没有编码RDE酶,所以它有用糖类分子进行继续扩散的概率,但是不大。
还有一个问题,是否存在抗体依赖的病毒感染增强效应(ADE),所谓ADE效应在登革热病毒里面是广为人知的,结合非中和性抗体的登革热病毒可以通过旁路进入巨噬细胞里面进行增殖,然后造成第二次感染,尤其是第二次感染和第一次感染的病毒株不一样的时候,第二次感染的症状更重,发生ADE效应。在冠状病毒里,新冠病毒目前不知道是不是有这种ADE的效应,但是对SARS病毒和MERS病毒已有研究发现S蛋白的低亲和力抗体,可以介导病毒进入免疫细胞,但并不能发生活跃复制,最终只发生流产感染。当然也可能会激起细胞因子等等反应,目前并不是很清楚。ADE的因素取决于抗体本身有多强,对下游信号的激活,尤其是ISG反应基因的激活程度等一系列因素,不光是对抗体治疗,对疫苗研发也是很重要的考量。
![首页 $SEO['title']](http://www.cnews123.com/statics/images/zgzixun21.png)